Briófitos y hongos (liquenizados y no liquenizados) del Parque Universitario Francisco Vivar Castro, Loja, Ecuador
Bryophytes and fungi (lichenized and non-lichenized) from “Parque Universitario Francisco Vivar Castro”, Loja, Ecuador
Ángel Benítez1
https://orcid.org/0000-0003-4579-1291
Darío Cruz1
https://orcid.org/0000-0003-1956-2882
Marlon Vega1
https://orcid.org/
https://orcid.org/0000-0002-6849-6589
Leonardo González 2
https://orcid.org/0000-0002-3820-4813
Nelson Jaramillo2
https://orcid.org/0000-0002-9715-5863
Fausto López1
https://orcid.org/0000-0002-9946-0992
Zhofre Aguirre2
https://orcid.org/0000-0002-6829-3028
1 BIETROP, Herbario HUTPL, Departamento de Ciencias Biológicas y Agropecuarias, Universidad Técnica Particular de
Loja, Ecuador.
2 Herbario Reinaldo Espinosa, Universidad Nacional de Loja, Loja, Ecuador
* Autor para correspondencia: arbenitez@utpl.edu.ec
https://doi.org/10.54753/blc.v11i2.1102
Recibido: 27-10-2021
Aceptado: 21-12-2021
RESUMEN
Los briófitos y hongos (liquenizados y no liquenizados) son altamente diversos en ecosistemas tropicales, y están relacionados con el funcionamiento de los mismos; sin embargo, la diversidad de estos organismos es aún poco estudiada en Ecuador. A nivel de país se ha reportado alrededor de 1700 especies de briófitos, 900 especies de líquenes y más de 2000 especies de hongos no liquenizados. Se realizó un inventario de briófitos, líquenes y hongos del Parque Universitario "Francisco Vivar Castro" en la Región Sur del Ecuador mediante colecciones al azar. Se registró un total de 152 especies, distribuidas en 74 briófitos, 40 líquenes y 38 macrohongos. Las familias con mayor número de especies de briófitos son Lejeuneaceae, Plagiochilaceae, Frullaniaceae, Radulaceae, Meterioraceae, Neckeraceae y Polytrichaceae. Para líquenes Physciaceae, Parmeliaceae, Lobariaceae y Ramalinaceae fueron las más representativas. Para hongos Polyporaceae, Physalacriaceae y Mycenaceae registraron el mayor número de especies. Concluimos que la zona del Parque Universitario "Francisco Vivar Castro" con las 152 especies alberga una alta diversidad de briofitos y hongos (líquenes y no liquenizados) siendo funcionalmente un refugio de biodiversidad en la hoya de Loja, como ya se ha documentado para plantas vasculares y algunos grupos de fauna. Bajo este contexto, la conservación del remanente de bosque de montaña, es necesario para preservar la alta diversidad de briófitos y hongos en Ecuador.
Palabras clave: hepáticas, líquenes, musgos, macrohongos, bosque secundario, Loja.
ABSTRACT
Bryophytes and fungi (lichenized and non-lichenized) are highly diverse in tropical ecosystems, and are related to their functioning; however, the diversity of these organisms is still little studied in Ecuador. At the country level, about 1700 species of bryophytes, 900 species of lichens and more than 2000 species of non-lichenized fungi have been reported. An inventory of bryophytes, lichens and fungi from the "Francisco Vivar Castro" University Park in the Southern Region of Ecuador was carried out through random collections. A total of 152 species were recorded, distributed in 74 bryophytes, 40 lichens and 38 macrofungi. The families with the highest number of bryophyte species are Lejeuneaceae, Plagiochilaceae, Frullaniaceae Radulaceae, Meterioraceae, Neckeraceae and Polytrichaceae. For lichens Physciaceae, Parmeliaceae, Lobariaceae and Ramalinaceae were the most representative. For fungi Polyporaceae, Physalacriaceae and Mycenaceae recorded the highest number of species. We conclude that the area of the "Parque Universitario Francisco Vivar Castro" with 152 species harbors a high diversity of bryophytes and fungi (lichens and non-lichenized) being functionally a refuge of biodiversity in the Loja basin, as already documented for vascular plants and some groups of fauna. In this context, the conservation of remaining mountain forest is necessary to preserve the high diversity of bryophytes and fungi in Ecuador.
Keywords: liverworts, lichens, mosses, macrofungi, secondary forests, Loja.
INTRODUCCIÓN
Ecuador es uno de los países con mayor biodiversidad de flora a nivel global con cerca de 18 000 especies de plantas vasculares bien documentadas (Ulloa et al., 2017), no así otros grupos como los briófitos y los hongos (liquenizados y no liquenizados) que han recibido poca atención en diferentes investigaciones relacionadas con la biodiversidad del país (Pillajo, 2001; Parolly et al., 2004; Benítez y Gradstein, 2011; Benítez et al., 2019; Vega et al., 2021)
En ese contexto, los briófitos con cerca de 1700 especies registradas en la actualidad (Churchill et al., 2000; León-Yanez et al., 2006; Gradstein, 2021) tienen el mayor número de especies, debido a que en los últimos años han recibido mayor atención el grupo de las hepáticas de Ecuador (Gradstein, 2021). Por otra parte, los hongos liquenizados (líquenes) con cerca de 900 especies reportadas para Ecuador continental (Cevallos, 2012) son el segundo grupo con mayor diversidad de especies. Finalmente, a pesar que los hongos no liquenizados son el grupo con mayor número de especies estimadas según la relación (9.1 hongos: 1 planta) (Hawksworth y Lücking, 2017), esperaríamos 146391.7 hongos, ya que poseemos según Jørgensen y León-Yánez (1999) 16087 plantas catalogadas para el Ecuador. A pesar de ello, para el país hasta la fecha se han catalogado oficialmente 813 especies (Ordoñez, 2018), así mismo 319 especies se han catalogado (116 ascomicetes y 203 basidiomicetes) del Herbario Nacional del Ecuador (QCNE) (Batallas-Molina et al., 2021) representando pobremente un 7.8 % del posible total de especies para el país. Los datos señalados anteriormente indican la falta de investigaciones en el campo de la briología, liquenología y micología en el país, y sobre todo en los bosques montanos que son considerados como puntos calientes de biodiversidad (Myers et al., 2000), fuertemente amenazados a nivel mundial, principalmente, por la deforestación (Brown y Kappelle, 2001; Tapia-Armijos et al., 2015).
En este sentido, un remanente de bosque montano localizado en el Parque Universitario "Francisco Vivar Castro" en el área urbana de la ciudad de Loja, registra una alta diversidad de plantas vasculares (Aguirre et al., 2017), gracias a varias investigaciones enfocadas a la diversidad y ecología de plantas vasculares (Aguirre Mendoza et al., 2017; Muñoz et al., 2021, Aguirre et al., 2021), sin embargo, hasta la fecha no existe un listado oficial de la diversidad de briófitos y hongos para este ecosistema, ya que solamente se ha realizado un estudio ecológico sobre la diversidad de briófitos epífitos en bosques secundarios y plantaciones de nogal donde se han registrado 55 especies (Medina et al., 2021). Por ello, el presente estudio tiene por objetivo realizar un inventario preliminar de la diversidad de briófitos y hongos (liquenizados y no liquenizados) del Parque Universitario "Francisco Vivar Castro" de la Región Sur del Ecuador, con la finalidad de generar patrones de diversidad como herramientas de conservación.
MATERIALES Y MÉTODOS
Área de estudio
La investigación se desarrolló en el Parque Universitario "Francisco Vivar Castro", (Figura 1), localizado en la parroquia San Sebastián, ciudad de Loja, propiedad de la Universidad Nacional de Loja, con una superficie de 99 ha, en un rango altitudinal de 2 130 a 2 520 m s.n.m., temperatura media anual de 16,6 °C, precipitación anual de 955 mm/año. Se diferencian cinco ecosistemas: bosque secundario, matorral alto y bajo, páramo antrópico y plantaciones forestales. Se encuentra entre las coordenadas UTM: 700592 – 9554223 N, 700970 – 9 553139 S, 701309 – 9553171 E, 699961 – 9554049 W (Aguirre et al., 2016).
En el área las familias representativas son Primulaceae, Araliaceae, Clethraceae, Asteraceae, Ericaceae, Melastomataceae, Pocaeae y Cyperaceae. Las especies más abundantes son: Alnus acuminata, Palicourea amethystina, Phenax laevigatus, Clethra revoluta y Clethra fimbriata (Aguirre et al., 2017).
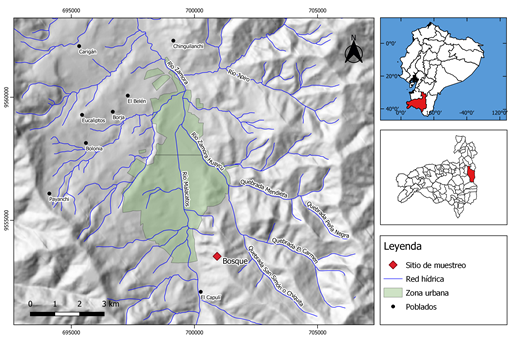
Figura 1. Localización del bosque montano en el Parque Universitario “Francisco Vivar Castro”
Recolección de datos
Se realizó colecciones al azar de briófitos y hongos (liquenizados y no liquenizados) en la zona de bosque secundario y plantaciones de nogal (Juglans neotropica Diels) así como en diferentes tipos de sustratos como suelo, corteza de árboles y madera en descomposición. Finalmente se elaboró un listado que incluyó la familia botánica, la formación vegetal y el sustrato donde crece.
RESULTADOS
Se registró un total de 152 especies, con 74 especies de briófitos, 40 especies de líquenes y 38 especies de hongos (Tabla 1).
Tabla 1. Especies de briófitos y hongos (liquenizados y no liquenizados) del parque Universitario "Francisco Vivar Castro". C= Coprofilo, E= Epífito, M= Madera y S= Suelo.
|
Especie |
Sustrato |
|
Briófitos |
|
|
Hepaticas talosas |
|
|
ANEURACEAE |
|
|
Riccardia digitiloba (Spruce) Pagan |
E, S |
|
DUMORTIERACEAE |
|
|
Dumortiera hirsuta (Sw.) Nees |
S |
|
MARCHANTIACEAE |
|
|
Marchantia chenopoda L. |
S |
|
Marchantia plicata Nees & Mont. |
S |
|
METZGERIACEAE |
|
|
Metzgeria dorsipara (Herzog) Kuwah. |
E |
|
Metzgeria leptoneura Spruce |
E |
|
MONOCLEACEAE |
|
|
Monoclea gottschei Lindb. |
E |
|
PALLAVICINIACEAE |
|
|
Symphyogyna brasiliensis Nees & Mont. |
S |
|
Symphyogyna brongniartii Mont. |
S |
|
Hepaticas foliosas |
|
|
ADELANTHACEAE |
|
|
Pseudomarsupidium decipiens (Hook.) Grolle |
E |
|
BALANTIOPSIDACEAE |
|
|
Isotachis multiceps (Lindenb. & Gottsche) Gottsche |
S |
|
Isotachis serrulata (Sw.) Gottsche |
S |
|
FRULLANIEACEAE |
|
|
Frullania brasiliensis Raddi |
E, S |
|
Frullania caulisequa (Nees) Mont. |
E |
|
Frullania ericoides (Nees) Mont. |
E |
|
Frullania riojaneirensis (Raddi) Ångstr. |
E |
|
Frullania subtilissima (Nees ex Mont.) Lindenb. |
E |
|
HERBERTACEAE |
|
|
Herbertus acanthelius Spruce |
S |
|
Herbertus pensilis (Taylor) Spruce |
S |
|
LEPICOLEACEAE |
|
|
Lepicolea pruinosa (Taylor) Spruce |
E, S |
|
LEPIDOZIACEAE |
|
|
Bazzania longistipula (Lindenb.) Trevis. |
E,S |
|
Telaranea nematodes (Austin) M.A.Howe |
|
|
LEJEUNEACEAE |
|
|
Bryopteris filicina (Sw.) Nees |
E |
|
Cheilolejeunea filiformis (Sw.) W. Ye, R.L. Zhu & Gradst. |
|
|
Dicranolejeunea axillaris (Nees & Mont.) Schiffn. |
E |
|
Drepanolejeunea cutervoensis (Loitl.) Grolle |
E |
|
Frullanoides densifolia Raddi subsp. densifolia. |
E |
|
Lejeunea cerina (Lehm. & Lindenb.) Lehm. & Lindenb. |
E |
|
Lejeunea deplanata Nees |
E |
|
Lejeunea flava (Sw.) Nees |
E |
|
Lejeunea laetevirens Nees & Mont. |
E |
|
Lejeunea ramulosa Spruce |
E |
|
Marchesinia brachiata (Sw.) Schiffner |
E |
|
Microlejeunea acutifolia Steph. |
E |
|
Microlejeunea bullata (Taylor) Steph. |
E |
|
LOPHOCOLEACEAE |
|
|
Leptoscyphus autoicus (J.J. Engel & Gradst.) Vanderp. & Gradst. |
E |
|
Lophocolea bidentata (L.) Dumort. |
E, S |
|
Lophocolea muricata (Lehm.) Nees |
E |
|
PLAGIOCHILACEAE |
|
|
Plagiochila aerea Taylor |
E |
|
Plagiochila bifaria (Sw.) Lindenb. |
E |
|
Plagiochila cristata (Sw.) Lindenb. |
E |
|
Plagiochila diversifolia Lindenb. & Gottsche |
E |
|
Plagiochila gymnocalycina (Lehm. & Lindenb.) Mont. & Nees |
E |
|
Plagiochila raddiana Lindenb. |
E |
|
PORELLACEAE |
|
|
Porella brachiata (Taylor) Spruce |
E |
|
Porella crispata (Hook.) Trevis. |
E |
|
RADULACEAE |
|
|
Radula episcia Spruce |
E |
|
Radula gottscheana Taylor |
E |
|
Radula tectiloba Steph. |
E |
|
Musgos |
|
|
BRYACEAE |
|
|
Bryum apiculatum Schwägr |
E |
|
Bryum argenteum Hedw. |
E, S |
|
CALYMPERACEAE |
|
|
Syrrhopodon incompletus Schwägr. |
E |
|
CRYPHAEACEAE |
|
|
Cryphaea jamesonii Taylor |
E |
|
DALTONIACEAE |
|
|
Adelothecium bogotense (Hampe) Mitt. |
E |
|
DICRANACEAE |
|
|
Campylopus flexuosus (Hedw.) Brid. |
E |
|
FABRONIACEAE |
|
|
Fabronia ciliaris (Brid.) Brid. |
E |
|
METEORIACEAE |
|
|
Meteoridium remotifolium (Müll. Hal.) Manuel |
E |
|
Squamidium leucotrichum (Taylor) Broth. |
E |
|
Squamidium nigricans (Hook.) Broth. |
E |
|
Zelometeorium recurvifolium (Hornsch.) Manuel |
|
|
MNIACEAE |
|
|
Plagiomnium rhynchophorum (Hook.) T.J. Kop. |
E, S |
|
NECKERACEAE |
|
|
Neckeropsis undulata (Hedw.) Reichardt |
E |
|
Porotrichum filiferum Mitt. |
E |
|
Porotrichum longirostre (Hook.) Mitt. |
E |
|
ORTHOTRICHACEAE |
|
|
Macromitrium richardii Schwägr. |
E |
|
POLYTRICHACEAE |
|
|
Atrichum androgynum (Müll.Hal.) Jaeger |
S |
|
Polytrichadelphus longisetus (Brid) Mitt |
S |
|
Polytrichum juniperinum Hedw. |
S |
|
POTTIACEAE |
|
|
Syntrichia fragilis (Taylor) Ochyra |
E |
|
SEMATOPHYLLACEAE |
|
|
Acroporium pungens (Hedw.) Broth. |
E |
|
Sematophyllum subsimplex (Hedw.) Mitt. |
E |
|
THUIDIACEAE |
|
|
Thuidium peruvianum Mitt. |
E, S |
|
Thuidium tomentosum Schimp. |
E, S |
|
Antocerotes ANTHOCEROTACEAE Anthoceros punctatus L. |
S |
|
Líquenes (hongos liquenizados) |
|
|
ARTHONIACEAE |
|
|
Arthonia cinnabarina (DC.) Wallr |
E |
|
Herpothallon rubrocinctum (Ehrenb.) |
E |
|
CANDELARIACEAE |
|
|
Candelaria concolor (Dicks.) B.Stein |
E |
|
COCCOCARPIACEAE |
|
|
Coccocarpia palmicola (Spreng.) Arv. & D.J. Galloway |
E |
|
Coccocarpia filiformis Arv. |
E |
|
COENOGONIACEAE |
E |
|
Coenogonium linkii Ehrenb. |
|
|
Coenogonium leprieurii (Mont.) Nyl. |
E |
|
Coenogonium pineti (Ach.) Lücking & Lumbsch |
E |
|
COLLEMATACEAE |
|
|
Leptogium azureum (Sw.) Mont. |
E |
|
Leptogium marginellum (Sw.) S.F.Gray |
E |
|
Leptogium phyllocarpum (Pers.) Mont. |
E |
|
GRAPHIDACEAE |
|
|
Graphis streblocarpa (Bél.) Nyl. |
E |
|
Glyphis cicatricosa Ach. |
E |
|
Phaeographis dendritica (Ach.) Müll. Arg. |
E |
|
LOBARIACEAE |
|
|
Lobariella pallida Hook. |
E |
|
Sticta andensis (Nyl.) Trevis. |
E, S |
|
Sticta fuliginosa (Dicks.) Ach. |
E |
|
Pseudocyphellaria crocata (L.) Vain. |
E |
|
Pseudocyphellaria aurata (Ach.) Vain |
E |
|
PANNARIACEAE |
|
|
Parmeliella miradorensis Vain. |
E |
|
PARMELIACEAE |
|
|
Bulbothrix coronata (Fée) Hale |
E |
|
Everniastrum vexans (Zahlbr. ex W.L. Culb. & C.F. Culb.) Hale ex Sipman |
E |
|
Parmotrema arnoldii (Du Rietz) Hale |
E |
|
Remototrachyna costaricensis (Nyl.) Divarkar & A.Crespo |
E |
|
Usnea laevis (Eschw.) Nyl. |
E |
|
|
|
|
PELTIGERACEAE |
|
|
Peltigera austroamericana Zahlbr. |
|
|
PHYSCIACEAE |
|
|
Heterodermia galactophylla (Tuck.) W.L. |
E |
|
Heterodermia isidiophora (Nyl.) D.D. Awasthi |
E |
|
Heterodermia japonica (M. Satô) Swinscow & Krog |
E |
|
Leucodermia leucomelos (L.) Kalb |
E |
|
Physcia aipolia (Ehrh. ex Humb.) Fürnr. |
E |
|
Physcia sorediosa (Vain.) Lynge |
E |
|
PYRENULACEAE |
|
|
Pyrenula tenuisepta R. C. Harris |
E |
|
RAMALINACEAE |
|
|
Phyllopsora isidiotyla (Vain.) Riddle |
E |
|
Phyllopsora parvifolia (Pers.) Mull. Arg. |
E |
|
Ramalina celastri (Spreng.) Krog & Swinscow |
E |
|
Ramalina peruviana Ach. |
E |
|
TELOSCHISTACEAE Teloschistes exilis (Michaux) Vainio |
E |
|
Teloschistes flavicans (Sw.) Norman |
E |
|
VERRUCARIACEAE |
|
|
Normandina pulchella (Borrer) Nyl. |
E |
|
Macrohongos (hongos no liquenizados) |
|
|
BOLBITIACEAE Conocybe apala (Fr.) Arnolds |
S |
|
BOLETINELLACEAE |
|
|
Boletinellus exiguous (Singer & Digilio) Watling |
S |
|
DACRYMYCETACEAE |
|
|
Calocera furcate (Fr.) Fr. |
M |
|
Dacryopinax spathularia (Schwein.) G.W. Martin |
M |
|
ENTOLOMATACEAE |
|
|
Rhodocybe pruinosistipitate T.J. Baroni, Largent & Aime |
S |
|
GEASTRACEAE |
|
|
Geastrum cf. saccatum Fr. |
S |
|
GOMPHACEAE |
|
|
Ramaria ochracea (Bres.) Corner |
S |
|
Ramaria pseudogracilis R.H. Petersen |
S |
|
HYDNANGIACEAE |
|
|
Laccaria laccata (Scop.) Cooke |
S |
|
HYMENOCHAETACEAE |
|
|
Coltricia perennis (L.) Murrill |
S |
|
IRPICACEAE |
|
|
Irpex lacteus (Fr.) Fr. |
M |
|
Hydnopolyporus fimbriatus (Cooke) D.A. Reid |
M |
|
LAETIPORACEAE |
|
|
Laetiporus sulphureus (Bull.) Murrill |
M |
|
MORCHELLACEAE |
|
|
Morchella cf fluvialis Clowez, P. Alvarado, M. Becerra, Bilbao & P.-A. Moreau |
S |
|
MYCENACEAE |
|
|
Favolaschia roseogrisea Singer |
M |
|
Mycena comata Har. Takah. & Taneyama |
M |
|
Panellus stipticus (Bull.) P. Karst. |
M |
|
MARASMIACEAE |
|
|
Chaetocalathus carnelioruber Singer |
M |
|
PHYSALACRIACEAE |
|
|
Oudemansiella canarii (Jungh.) Höhn. |
M |
|
Coprinellus disseminatus (Pers.) J.E. Lange |
S |
|
Physalacria aggregate G.W. Martin & A.C. Baker |
M |
|
POLYPORACEAE |
|
|
Cerioporus flavus (Sw.) Zmitr. |
M |
|
Favolus tenuiculus P. Beauv. |
M |
|
Hexagonia tenuis (Fr.) Fr. |
M |
|
Lentinus crinitus (L.) Fr. |
M |
|
Pycnoporus sanguineus (L.) Murrill RHIZOPOGONACEAE Rhizopogon luteolus Fr. |
S |
|
SCHIZOPHYLLACEAE |
|
|
Schizophyllum commune Fr. |
M |
|
SCLERODERMATACEAE |
|
|
Scleroderma citrinum Pers. |
S |
|
STEREACEAE |
|
|
Stereum hirsutum (Willd.) Pers. |
M |
|
STROPHARIACEAE |
|
|
Deconica coprophila (Bull.) P. Karst. |
C |
|
Stropharia aurantiaca sensu auct. |
S |
|
THELEPHORACEAE |
|
|
Thelephora cf. terrestris Ehrh. |
S |
|
TREMELLACEAE |
|
|
Tremella fuciformis Berk. |
M |
|
XYLARIACEAE |
|
|
Xylaria hypoxylon (L.) Grev. |
M |
|
INCERTAE SEDIS |
|
|
Calyptella campanula (Nees) W.B. Cooke |
M |
|
Rimbachia cf. bryophila (Pers.) Redhead |
S |
|
Trogia papyracea (Berk. & M.A. Curtis) Corner |
M |
 |
Figura 2. A Dumortiera hirsuta; B Marchantia chenopoda; C Monoclea gottschei; D Symphyogyna brasiliensis; E Frullania brasiliensis; F Plagiochila diversifolia; G Radula aff. gottscheana; H Cheilolejeunea filiformis
 |
Figura 3. A Adelothecium bogotense; B Atrichum androgynum; C Bryum apiculatum; D Neckeropsis undulata; E Plagiomnium rhynchophorum; F Polytrichum juniperinum; G Syntrichia fragilis; H Thuidium peruvianum
 |
Figura 4. A Arthonia cinnabarina; B Coccocarpia palmicola; C Coenogonium linkii; D Herpothallon rubrocinctum; E Leucodermia leucomelos; F Leptogium azureum; G Lobariella pallida; H Parmotrema arnoldii
 |
Figura 5. A Peltigera austroamericana; B Phaeographis dendritica; C Physcia aipolia; D Pseudocyphellaria aurata; E Sticta fuliginosa; F Ramalina celastri; G Teloschistes exilis; H Usnea laevis

Figura 6. A-B Conocybe apala; C-D Suillus luteus; E Schizophyllum commune; F-G Calyptella campanula; H Cerioporus flavus; I Coltricia perennis; J Stereum hirsuta; K Favolaschia roseogrisea; L Hymenogloea papyracea; LL Geastrum saccatum; M Tremella fuciformis;N Irpex lactea; O Laccaria laccata; P Leratomyces ceres; Q Rimbachia cf. Bryophila; R Mycena comata; S Physalacria aggregata; T Ramaria ochracea; Scleroderma citrinum.
DISCUSIÓN
A pesar de ser un inventario preliminar se registró un alto número de especies en el bosque montano, similar a estos resultados varios autores señalan que los bosques de montaña son considerados muy diversos en briófitos (Holz y Gradstein, 2005; Nöske et al., 2008; Gradstein, 2021), líquenes (Benitez et al., 2012; 2015) y hongos preferencialmente registrados con datos moleculares (Liede-Schumann y Breckle, 2008; Cruz et al., 2016). En cuanto a briófitos para el grupo de hepáticas, las familias más diversas fueron Lejeuneaceae, Plagiochilaceae, Frullaniaceae y Radulaceae (Figura 2, Tabla 1); de manera similar Gradstein (2021) señala a estas familias como las más diversas en Ecuador.
En cuanto a musgos, las familias Meterioraceae, Neckeraceae y Polytrichaceae (Figura 3) fueron las más diversas, las mismas que se han reportado en otros estudios para los bosques de montaña (Holz y Gradsten, 2005; Benítez et al., 2015).
Las familias Physciaceae, Parmeliaceae, Lobariaceae y Ramalinaceae (Figura 4 y 5) fueron las más representativas para líquenes, situación similar indican Nöske et al. (2007) y Benítez et al. (2012) en sus estudios para bosques montanos tropicales de Ecuador, donde las familias señaladas anteriormente fueron las más dominantes (Benítez et al., 2015).
Las familias Polyporaceae, Physalacriaceae y Mycenaceae (Figura 6, Tabla 1) presentaron el mayor número de especies (38 en total) para los hongos, coincidentemente similar a las familias reportadas por Batallas-Molina et al. (2021) quien señala a Polyporaceae dentro de Basidiomycota como la más diversa para Ecuador seguido de Physalacriaceae y Mycenaceae parte de las familias más diversas como ya lo describe también Ordoñez (2018).
CONCLUSIONES
En el remanente de bosque se registró 152 especies (74 briófitos, 40 líquenes y 38 macrohongos), donde las familias con mayor número de especies de briófitos fueron Lejeuneaceae, Plagiochilaceae, Frullaniaceae Radulaceae, Meterioraceae, Neckeraceae y Polytrichaceae. Las familias Physciaceae, Parmeliaceae, Lobariaceae y Ramalinaceae fueron las más representativas en cuanto a líquenes. Por otra parte, la familia Polyporaceae, Physalacriaceae y Mycenaceae registraron el mayor número de especies. En este contexto, el bosque montano del Parque Universitario "Francisco Vivar Castro" no solo alberga una alta diversidad de plantas vasculares, sino también una gran riqueza de especies de briofitos y hongos (líquenes y no liquenizados), por lo que funciona como refugio de biodiversidad, debido a que es uno de los pocos remanentes boscosos en la hoya de Loja el cual cuenta con estrategias apropiadas de manejo y conservación.
AGRADECIMIENTOS:
Agradecemos a la Universidad Técnica Particular de Loja por el financiamiento para realizar la investigación (PROY_INV_CCBIO_2020_2773) y también a la Universidad Nacional de Loja. Un agradecimiento especial al Magister Ramiro Morocho Cuenca por la elaboración del mapa del área de estudio y al Ministerio de Ambiente, Agua y Transición Ecológica por otorgar el permiso de investigación (MAE-ARSFC-2021-1536).
BIBLIOGRAFÍA
Aguirre Mendoza, Z. A., Nivelo, L. G., Díaz, N. J., y Tamayo, J. P. (2021). Monitoreo de la sucesión de especies vegetales leñosas bajo una plantación de Pinus radiata D. Don, en el parque universitario “Francisco Vivar Castro”, provincia de Loja, Ecuador. South Florida Journal of Development, 2(1), 1018-1039.
Aguirre Mendoza, Z., Reyes Jiménez, B., Quizhpe Coronel, W., y Cabrera, A. (2017). Composición florística, estructura y endemismo del componente leñoso de un bosque montano en el sur del Ecuador. Arnaldoa, 24(2), 543-556.
Aguirre Z., Yaguana C., y Gaona T. (2016). Parque Universitario de Educación Ambiental y Recreación Ing. Francisco Vivar Castro. Universidad Nacional de Loja, Loja, Ecuador.
Batallas-Molina, R., Moya-Marcalla, G.F., y Navas-Muñoz, D. (2021). Catálogo de hongos (Ascomycota y Basidiomycota) de la Colección Micológica del Herbario Nacional del Ecuador (QCNE) del Instituto Nacional de Biodiversidad (INABIO). ACI Avances En Ciencias E Ingenierías, 12(1), 38-71.
Benítez, Á., Gradstein, S. R., Cevallos, P., Medina, J., y Aguirre, N. (2019). Terrestrial bryophyte communities in relation to climatic and topographic factors in a paramo of southern Ecuador. Caldasia, 41(2), 370-379.
Benítez, Á., Prieto, M., González, Y., & Aragón, G. (2012). Effects of tropical montane forest disturbance on epiphytic macrolichens. Science of The Total Environment, 441, 169-175.
Benítez, A., Prieto, M., y Aragón G. (2015). Large trees and dense canopies: Key factors for maintaining high epiphytic diversity on trunk bases (bryophytes and lichens) in tropical montane forests. Forestry 88(5),521-527.
Benítez, A., y Gradstein, S. R. (2011). Adiciones a la flora de briófitas del Ecuador. Cryptogamie, Bryologie, 32(1), 65-74.
Brown, A.D., Kappelle, M. Introducción a los bosques nublados del neotrópico: Una síntesis regional. In Bosques nublados del Neotrópico; Kappelle, M., Brown, A.D., Eds.; Instituto Nacional de Biodiversidad (INBio): Santo Domingo de Heredia, Costa Rica.
Cevallos, G. (2012). Checklist de líquenes y hongos liquenícolas de Ecuador Continetal (tesis de maestría), Universidad Rey Juan Carlos. Móstoles, Madrid, España.
Churchill, S., Griffin, D., y Muñoz, J. (2000). A checklist of the mosses of the tropical Andean countries. Ruizia, 17, 1-203.
Cruz, D., Suárez, J., y Piepenbring, M. (2016). Morphological revision of Tulasnellaceae, with two new species of Tulasnella and new records of Tulasnella spp. for Ecuador. Nova Hedwigia 102: 279–338.
Gradstein, S. R. (2021). The liverworts and hornworts of Colombia and Ecuador (Vol. 121). Springer Nature.
Gradstein, SR., Churchill S., y Salazar A. (2001). Guide to the Bryophytes of Tropical America. Men. New York Bot. Garden, 86, 1-577.
Hawksworth, D. L., y Lücking, R. (2017). Fungal diversity revisited: 2.2 to 3.8 million species. Microbiology Spectrum, 5(4), 5-4.
Holz, I., y Gradstein, R. S. (2005). Cryptogamic epiphytes in primary and recovering upper montane oak forests of Costa Rica–species richness, community composition and ecology. Plant Ecology, 178(1), 89-109.
Jørgensen, P.M., y León-Yánez S. (1999). Catalogue of the vascular plants of Ecuador. Monogr. Syst. Bot. Missouri Bot. Gard. 75: i–viii, 1–1182.
León-Yánez, S., Gradstein, R., y Wegner, C. (2006). Hepáticas (Marchantiophyta) y Antoceros (Anthocerotophyta) del Ecuador, catálogo. Publicaciones del Herbario QCA, Pontificia Universidad Católica del Ecuador, Quito.
Liede-Schumann, S., & Breckle, S.-W. (Eds.). (2008). Provisional checklists of flora and fauna of the San Francisco Valley and its surroundings: (Reserva Biológica San Francisco, Prov. Zamora-Chinchipe, southern Ecuador). Ecotropical monographs (Vol. 4). Bonn, Germany: Society of Tropical Ecology.
Medina, J., Quizhpe, W., Déleg, J., Gonzalez, K., Aguirre, Z., Aguirre, N., ... y Benítez, Á. (2021). Are Juglans neotropica Plantations Useful as a Refuge of Bryophytes Diversity in Tropical Areas?. Life, 11(5), 434.
Muñoz, J., Mocha, J., Quichimbo, L., Muñoz, L., y Aguirre, Z. (2021). Composición florística del banco de semillas del suelo en el Bosque Montano del Parque Universitario" Francisco Vivar Castro" de la ciudad de Loja. Bosques Latitud Cero, 11(1), 113-127.
Myers, N., Mittermeier, R. A., Mittermeier, C. G., Da Fonseca, G. A., y Kent, J. (2000). Biodiversity hotspots for conservation priorities. Nature, 403(6772), 853-858.
Nöske, N. M., Hilt, N., Werner, F. A., Brehm, G., Fiedler, K., Sipman, H. J., y Gradstein, S. R. (2008). Disturbance effects on diversity of epiphytes and moths in a montane forest in Ecuador. Basic and Applied Ecology, 9(1), 4-12.
Nöske, N., Gradstein, R., Kürschner, H., Parolly, G., y Torracchi, S. (2003). Cryptogams of the Reserva Biológica San Francisco (Province Zamora-Chinchipe, Southern Ecuador). I. Cryptogamie, Bryologie, 24, 15-32.
Ordoñez, M. E. 2018. Fungi del Ecuador. Versión 2018.0. Fungario QCAM, Pontificia Universidad Católica del Ecuador. Recuperado de https:bioweb.bio/fungiweb
Parolly, G., Kürschner, H., Schäfer-Verwimp, A., y Gradstein, R. (2004). Cryptogams of the Reserva Biológica San Francisco (Province Zamora-Chinchipe, Southern Ecuador). III. Bryophytes: Additions and new species. Cryptogamie, Bryologie, 25, 271-289.
Pillajo, I. (2001). Diversidad de Hongos macroscópicos en una hectárea de bosque amazónico, Ecuador. Cinchonia, 2(1), 98-105.
Tapia-Armijos, M. F., Homeier, J., Espinosa, C. I., Leuschner, C., y de la Cruz, M. (2015). Correction: Deforestation and Forest Fragmentation in South Ecuador since the 1970s-Losing a Hotspot of Biodiversity. Plos One, 10(11), e0142359.
Ulloa, C. U., Acevedo-Rodríguez, P., Beck, S., Belgrano, M. J., Bernal, R., Berry, P. E., ... y Jørgensen, P. M. (2017). An integrated assessment of the vascular plant species of the Americas. Science, 358(6370), 1614-1617.
Vega, M., Déleg, J., y Benítez, Á. (2021). Primer registro del liquen Pyrenula hirsuta para Sudamérica. Neotropical Biodiversity, 7(1), 75-77.