Control of phenolic oxidation of Handroanthus heptaphyllus nodal segments under in vitro conditions
Keywords:
Explants, White-flowered lapacho, Micropropagation, Parent plants, Phenolic oxidationAbstract
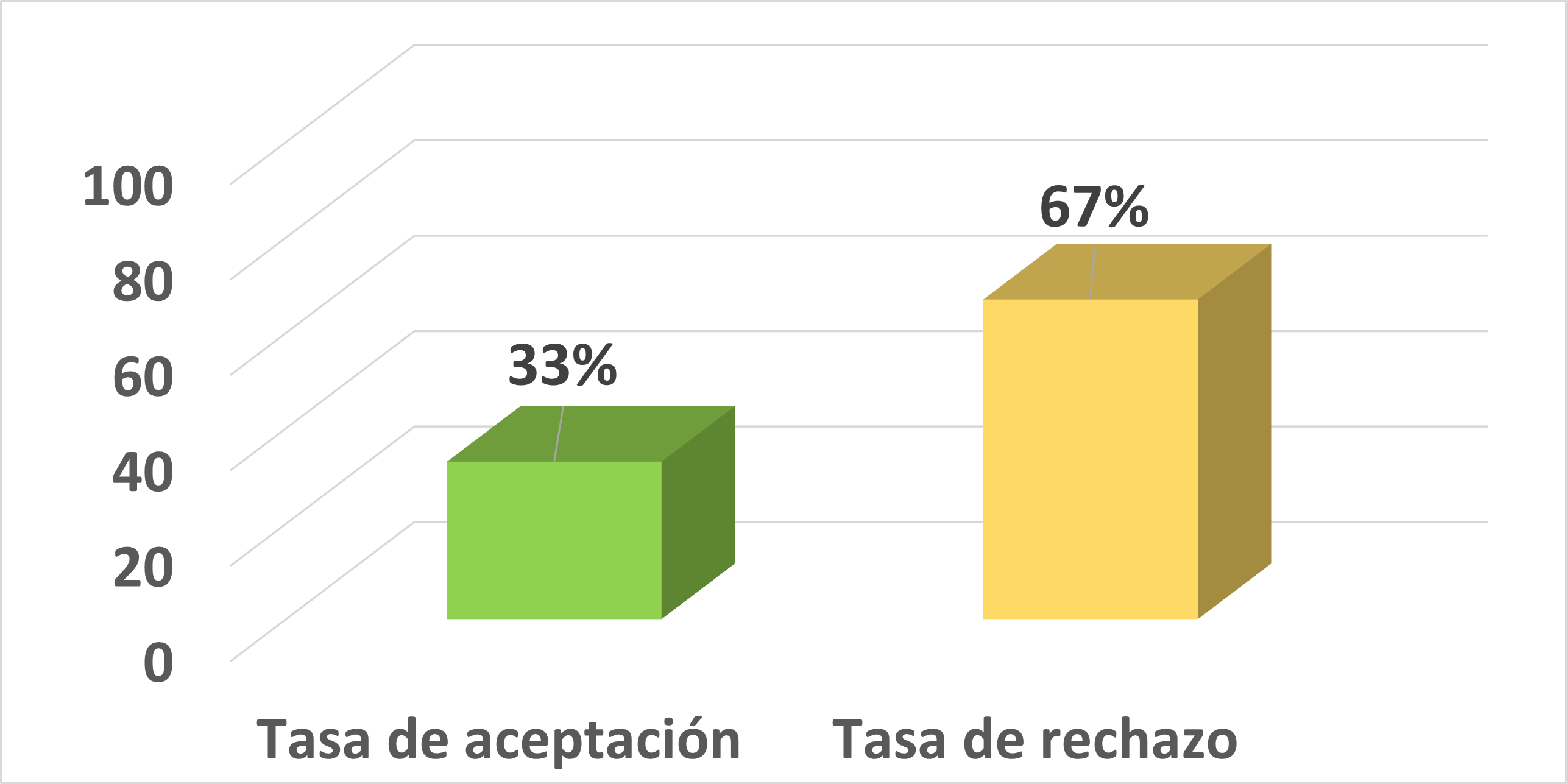
In vitro culture could become a viable option in the mass production of Handroanthus heptaphyllus (Vell.) Mattos (whiteflowered lapacho), an indigenous species from Paraguay, from the family Bignoniaceae. This species possesses a unique characteristic due to its white inflorescences, which are observed in a few specimens of the genus. The objective of the present work was to establish a protocol for the control of in vitro oxidation of Handroanthus heptaphyllus nodal segments by using activated charcoal in different concentrations (1, 2, 3 and 4 g.L-1) in Murashige and Skoog culture medium. A total of 40 nodal segments were used from parent plants that were kept in the nursery. These parent plants were treated with the application of mancozeb at 3 g.L-1. The variables measured were oxidation and survival up to 35 days of incubation. Analysis of variance and Tukey test were performed with a confidence level of 5%. Statistical analyses showed significant differences in oxidation control. The 3 g.L-1 concentration of activated charcoal has been the most effective.References
Abdelwahd, R; Hakam, N; Labhilili, M; UduPA, S. (2008). Use of an adsorbent and antioxidants to reduce the effects of leached phenolics in vitro plantlet regeneration of faba bean. African Journal of Biotechnology 7: 997-1002.
Azofeifa, A. (2009). Problemas de oxidación y oscurecimiento de explantes cultivados in vitro. Agronomía Mesoamericana. Consultado 26 jun 2013. Disponible en http://www.mag.go.cr/rev$_$meso/v20n01$_$153.pdf
Barbón, R (2011) Embriogénesis somática de Swietenia mahoganii (L. Jacq.) en medios de cultivo semisólidos. Revista Forestal Baracoa 30: 124
Cabral, E. L.; Barbosa, D. C. A.; Simabukuro, E. A. (2003). Armazenamento e germinação de sementes de Tabebuia aurea (manso) Benth. & Hook. f. ex. S. Moore. Acta Botânica Brasílica, v.17, p.609-617.
Carvalho P (1994) Espécies Florestais Brasileiras: recomendações silviculturais, potencialidades e uso da madeira. Colombo: Embrapa. 640 p.
Carvalho, P.E.R. (2003). Espécies arbóreas brasileiras. Brasilia, BR Embrapa Informação Tecnológica. p. 567-572.
Chagas, CJ; Medeiros, AM; Lacerda, M. (2006). Factores Inerentes À Micropropagação. Campina Grande. PB. BR. EMBRAPA. Consultado 15 mayo 2013.
Daquinta, M, Ramos L, Lezcano Y, Rodriguez R, Escalona M (2000) Algunos elementos en la micropropagación de la teca. Biotecnología vegetal 1(1): 39-44
Díaz Lezcano, M., Rodas Ramirez, J., González Segnana, L., & Vera de Ortiz, M. (2020). Establecimiento in vitro de segmentos nodales de Handroanthus heptaphyllus de flores blancas. Biotecnología Vegetal, 20 (3), 203-210. Disponible en: https://revista.ibp.co.cu/index.php/BV/article/view/672
Díaz Lezcano MI, Vera Arza DM, González Espínola DD, López Talavera CA. (2021). Micropropagación de Handroanthus heptaphyllus (VELL.) Mattos a partir de segmentos nodales. Rev. Soc. cient. Parag.; 26(1):49-63
Duarte E., Avico E., Sansberro P., Luna C. (2014). Efecto de la testa sobre la germinación de la ssemillas de Handroanthus heptaphyllus tras distintos tiempo de almacenamiento. Ciencias Agronómicas - Revista XXIV -29: 029 - 035
Farjon, A (2003) The remaining diversity of conifers. Acta Horticulturae (ISHS) 615: 75-89
Fiori Fernández, C, Díaz Lezcano, MI, González Segnana, LR (2016). Enraizamiento in vitro de embriones cigóticos de Acrocomia aculeata (Jacq.) Lodd ex Mart. Colombia Forestal. Bogotá-Colombia. Vol. 19 (1) 67-78 pp.
Jiménez-Terry, F., & Agramonte, D. (2013). Cultivo in vitro y macropropagación como vía de sostenibilidad de la propagación de especies forestales. Biotecnología Vegetal, 13(1). Disponible en: https://revista.ibp.co.cu/index.php/BV/article/view/89/456
Hernández, Yuniet, & González, María E. (2010). Efectos de la contaminación microbiana y oxidación fenólica en el establecimiento in vitro de frutas perennes. Cultivos Tropicales, 31(4), 00. Disponible en: http://scielo.sld.cu/scielo.php?script=sci$_$arttext&pid=S0258-59362010000400015&lng=es&tlng=es.
Larraburu, EE (2014) Morfogénesis in vitro de Handroanthus impetiginosus (Mart. ex DC.) Mattos (Bignoniaceae). Tesis Doctoral. Universidad Nacional de Luján. Luján. Argentina.
López, JA; Little Junior, EL; Ritz, JGF; Rombold, JS, Hahn, W. (2002). Árboles comunes del Paraguay: ñandeyvyra mata kuéra. 2 ed. Asunción, PY, Cuerpo de Paz. 458 p.
Martins, Leila, Lago, Antonio A. do, & Cícero, Silvio M.. (2012). Conservação de sementes de ipê-roxo. Revista Brasileira de Engenharia Agrícola e Ambiental, 16(1), 108-112. https://doi.org/10.1590/S1415-43662012000100014
Roca, M, Mroginski, A (1991) Principios básicos, metodologías y técnicas del cultivo de tejidos vegetales (en línea). CO. CIAT. Consultado 06 jul. 2013. Disponible en http://ciat-library.ciat.cgiar.org/documentos$_$electronicos$_$ciat/isbn958-9183-15-8/capitulo1.pdf
Teixeira, JB. 2006. Limitações ao processo de cultivo in vitro de espécies lenhosas.EMBRAPA Recursos Genéticos e Biotecnologia. 8 p. Consultado 20 abr. 2012. Disponible en: es.scribd.com/doc/60042247/limitacoes-na-cultura-in-vitro-de-lenhosas
Villalobos, V, Thorpe, T (1993) Micropropagación: conceptos, metodología y resultados (en línea). In Roca, WM; Mroginski, LA. Cultivo de tejidos en la agricultura: fundamentos y aplicaciones. Cali, CO, CIAT. Consultado el: 11 set 2013.
Zichner, A, Díaz Lezcano, MI, González Segnana, LR, Vera de Ortiz, M (2012) Efecto del carbón activado en el control de la oxidación de segmentos nodales de Eucalyptus grandis Hill ex Maidenida en el listado? cultivados in vitro. Revista de Investigación Agrarias. 12(2):107-111. San Lorenzo, Paraguay
Published
How to Cite
Issue
Section
License

This work is licensed under a Creative Commons Attribution-NonCommercial-NoDerivatives 4.0 International License.
Those authors who have publications with this journal, accept the following terms:
- After the scientific article is accepted for publication, the author agrees to transfer the rights of the first publication to the CEDAMAZ Journal, but the authors retain the copyright. The total or partial reproduction of the published texts is allowed as long as it is not for profit. When the total or partial reproduction of scientific articles accepted and published in the CEDAMAZ Journal is carried out, the complete source and the electronic address of the publication must be cited.
- Scientific articles accepted and published in the CEDAMAZ journal may be deposited by the authors in their entirety in any repository without commercial purposes.
- Authors should not distribute accepted scientific articles that have not yet been officially published by CEDAMAZ. Failure to comply with this rule will result in the rejection of the scientific article.
- The publication of your work will be simultaneously subject to the Attribution-NonCommercial-NoDerivatives 4.0 International (CC BY-NC-ND 4.0)